У большинства бактерий клеточная стенка окружает клетку в виде плотной оболочки, защищающей от вредных внешних воздействий, и предотвращает разрыв плазматической мембраны под влиянием высокого внутреннего осмотического давления.
Стабильность структуры клеточной стенки обеспечивается в основном муреином (пептидогликаном), имеющим вид решетки. Он состоит из основных «строительных блоков», связанных вместе, которые образуют большую макромолекулу. Каждая основная единица содержит два связанных аминоуглевода N ацетилглюкозамина и N-ацетилмурамовой кислоты; последняя имеет пептидную цепь. «Строительные блоки» синтезируются в бактериях, переносятся наружу через клеточную мембрану и собираются, как показано на схеме.
Транспептидаза сшивает пептидные цепи соседних цепей аминосахаров. Бактерии, которые окрашиваются грамотрицательно, имеют дополнительную мембрану поверх муреинового слоя. Она блокирует доступ многим антибиотикам к грамотрицательным бактериям. Эта мембрана состоит из фосфолипидного бислоя, содержащего белки (в т. ч. транспортные, которые позволяют антибиотикам преодолевать ее) вместе с липополисахаридами.
Ингибиторы синтеза клеточной стенки являются избирательными антибактериальными препаратами, т. к. у животных и у человека клеточная стенка отсутствует. Эти препараты оказывают бактерицидное действие на растущие и размножающиеся бактерии. К представителям данного класса относятся β-лактамные антибиотики, например пенициллины, цефалоспорины и атипичные β-лактамы, а также ванкомицин и бацитрацин.
а) Пенициллины. Исходным веществом данной группы является бензилпенициллин (пенициллин G). Он был впервые получен из культур плесневых грибов Penicillinum notatum. Бензилпенициллин имеет основную структуру, общую для всех пенициллинов, а именно 6-аминопенициллиновую кислоту, содержащую тиазолид и 4-членное β-лактамное кольцо. 6-аминопенициллиновая кислота сама по себе не обладает антибактериальной активностью.
Пенициллины нарушают синтез клеточной стенки за счет ингибирования транспептидазы. Бактерицидное действие пенициллинов проявляется при росте бактерий и в фазе репликации. В результате нарушения целостности клеточной стенки бактерии набухают и разрываются.
Пенициллины, как правило, хорошо переносятся. Суточная доза бензилпенициллина варьирует от 0,6 г в/м (10 6 ME, 1 мегаЕД) до 60 г в виде инфузии. В основе наиболее значимых побочных эффектов лежит гиперчувствительность (частота до 5%) с проявлениями от кожной сыпи до анафилактического шока ( 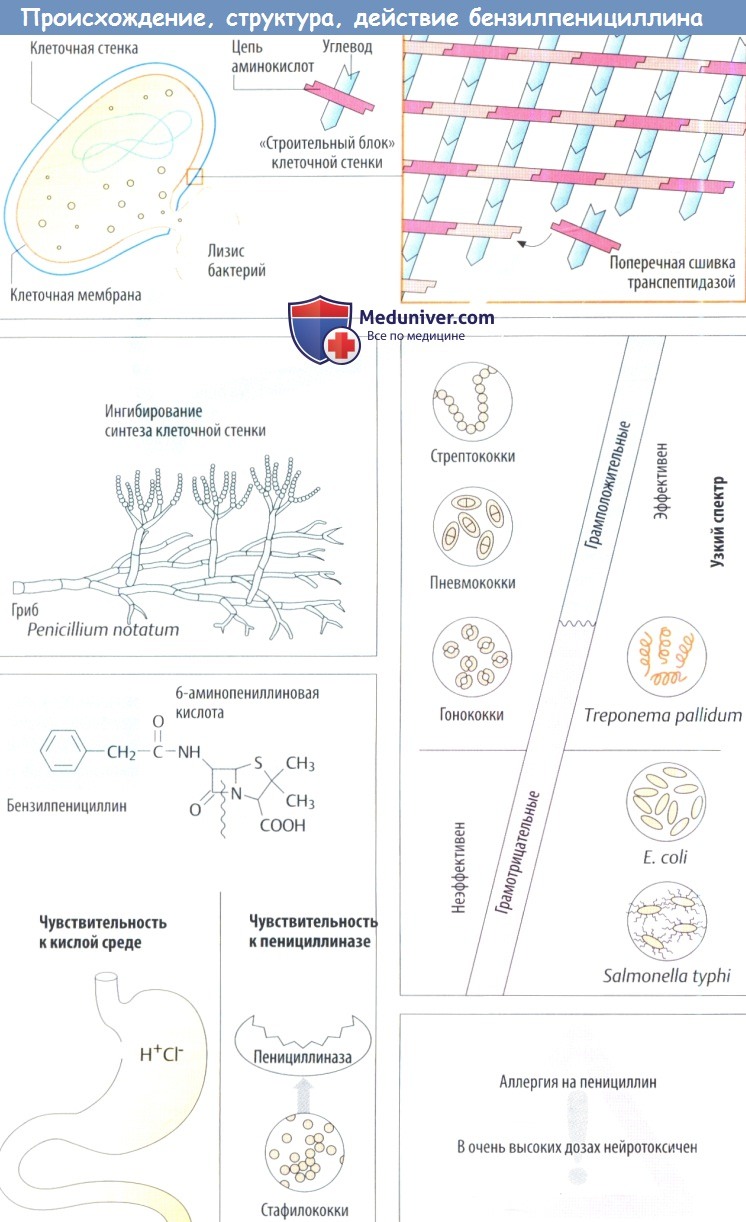
Для расширения диапазона дозы с сохранением необходимогоуровня антибактериального препарата пенициллины могут вводиться в высокой дозе в силу широкой терапевтической границы безопасности. Существуют пролонгированные препараты для в/м введения (продолжительность действия прокаин-бензилпенициллина составляет 1 день, а бензатин-бензилпенициллина — 7-28 дней). Одновременное введение пробенецида для ингибирования переносчика анионов в почках задерживает выделение пенициллина.
Несмотря на очень хорошую переносимость, у бензилпенициллина имеются недостатки, которые ограничивают его терапевтическую полезность:
1. Он инактивируется кислотой желудка, которая отщепляет р-лактамное кольцо, что делает необходимым в/в введение.
2. β-лактамное кольцо также разрушается бактериальными ферментами (р-лактамазами), в частности пенициллиназой, которая образуется штаммами стафилококка, обеспечивая их резистентность к бен-зилпенициллину.
3. Узкий антибактериальный спектр, и несмотря на то что он охватывает многие грамположительные бактерии, грамотрицательные кокки и спирохеты, вне поражения остаются многие грамотрицательные возбудители.
Производные пенициллина с различными заместителями 6-аминопенициллиновой кислоты обладают рядом преимуществ.
1. Резистентность в кислой среде позволяет вводить препарат внутрь при условии возможности кишечного всасывания. Многие производные, показанные на рисунке ниже, вводятся внутрь. Пенициллин V (феноксиметил пенициллин) обладает такими же антибактериальными свойствами, что и бензилпенициллин.
2. Благодаря резистентности к пенициллиназе изоксазолилпенициллины (оксациллин, диклоксациллин, флоксациллин) подходят для (перорального) лечения инфекций, вызванных продуцирующими пенициллиназу стафилококками.
3. Расширенный спектр активности: аминопенициллин амоксициллинактивен против многих грамотрицательных организмов, например бактерий группы кишечной палочки или Salmonella typhi.
Амоксициллин устойчив в кислой среде и хорошо всасывается в кишечнике, т. к. транспортируется ди-пептидным переносчиком. Ампициллин обладает аналогичным спектром активности, но из-за плохой всасываемости ( 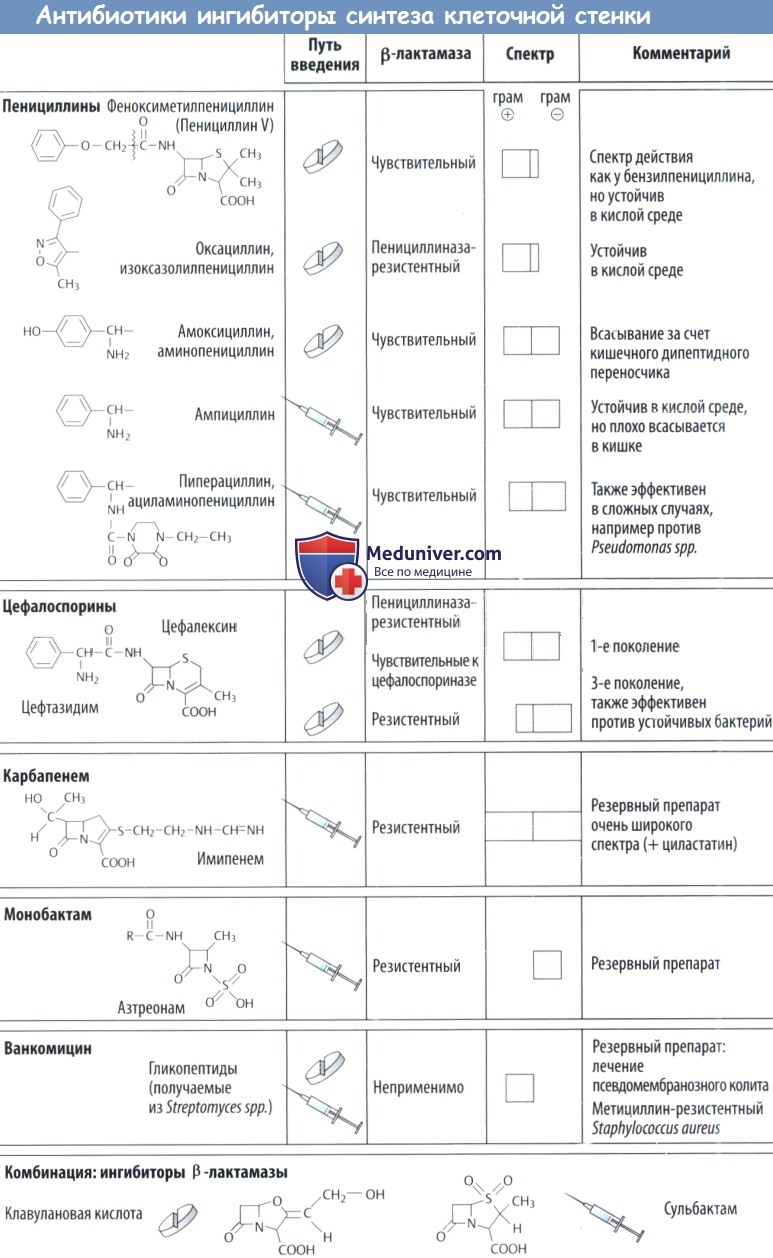
Большинство бактерий, в отличие от клеток организма человека, кроме клеточной мембраны (цитоплазматическая мембрана) имеют снаружи клеточную стенку (Mycoplasma pneumoniae не имеет клеточной стенки).
Грамотрицательные бактерии имеют дополнительно наружную оболочку (наружную мембрану), состоящую из липополисахаридов. Через поры наружной мебраны могут проходить гидрофильные вещества. В микобактериях наружная мембрана в значительной степени состоит из миколиевых кислот (жирные кислоты).
Клеточная стенка на 50 % состоит из слоев пептидогликана (муреин; от лат. murus – стена) – длинные цепи дисахарида, соединенные пептидными мостиками.
В грамположительных бактериях давление внутри клеток составляет около 20 атм., и клеточная стенка содержит до 40 слоев пептидогликана. В грамотрицательных бактериях давление внутри клеток составляет около 5 атм., и клеточная стенка содержит несколько слоев пептидогликана.
Пептидогликан состоит из цепочек, образованных повторяющимся (до 60 раз) комплексом двух аминосахаров – Ν-ацетилмурамовой кислоты и Ν-ацетилглюкозамина. К каждой молекуле Ν-ацетилмурамата присоединен тетрапептид. Между тетрапептидами соседних цепочек при участии транспептидазы образуются пептидные мостики. Таким образом пептидогликан образует прочный каркас клеточной стенки (рис. 81).

Рис. 81. Схема структуры пептидогликана. AM – Ν-ацетилмурамат; АГ – Ν-ацетилглюкозамин.
Образование пептидогликана начинается в цитоплазме. К Ν-ацетилмурамату присоединяется вначале трипептид, а затем еще 2 аминокислоты – D-ala-D-ala (в дальнейшем 5-я аминокислота – D-ala – удаляется). К тому соединению присоединяется за счёт двойной фосфатной связи липидный пирофосфатный переносчик С55 (содержит 55 атомов углерода), который осуществляет транспорт фрагмента пептидогликана через плазматическую мембрану в клеточную стенку. В плазматической мембране к Ν-ацетилмурамату присоединяется Ν-ацетилглюкозамин, а затем боковой пентапептид, соединенный с 3-й аминокислотой пентапептида Ν-ацетилмурамата. Образовавшийся блок пептидогликана переносится в клеточную стенку, где встраивается в общую структуру пептидогликана с помощью транспептидаз, которые соединяют боковой пентапептид с тетрапептидом одного из Ν-ацетилмураматов основного массива пептидогликана. После этого липидный транспортер С55 дефосфорилируется специальной фосфатазой и вновь участвует в транспорте блоков пептидогликана.
При делении микробных клеток аутолитические ферменты (аутолизины, в частности, L-аланинамидаза) разрушают пептидные связи между цепями пептидогликана. Активность аутолизинов уменьшается под влиянием специального ингибитора.
Средства, нарушающие клеточную стенку бактерий, препятствуют синтезу пептидогликана или нарушают связи между цепями пептидогликана.
При этом прочность клеточной стенки снижается и растущие бактерии гибнут.
К антибиотикам, нарушающим клеточную стенку бактерий, относятся:
1) бета-лактамные антибиотики;
2) гликопептидные антибиотики;
5) производные фосфоновой кислоты.
Бета-лактамные антибиотики
Молекулы этих антибиотиков содержат бета-лактамное кольцо – лактонный цикл, включающий аминогруппу в бета-положении (бета-лактамины).
Бета-лактамные антибиотики ингибируют транспептидазы, участвующие в синтезе пептидогликана клеточной стенки бактерий и таким образом нарушают синтез пептидогликана. Кроме того, бета-лактамные антибиотики ингибируют ингибитор аутолизинов, которые в норме участвуют в расщеплении пептидогликана при делении клеток. При этом аутолизины активируются. Нарушение синтеза пептидогликана и активация аутолизинов приводят к разрушению клеточной стенки бактерий и лизису бактерий.
Среди бета-лактамных антибиотиков выделяют:
Пенициллины
В 1928 г. Alexander Fleming (Великобритания) обнаружил в чашке Петри с культурой стафилококков противомикробные свойства зеленой плесени (Penicillium), выделил чистую культуру зеленой плесени и назвал её пенициллином. В 1940 г. его соотечественники Н. W. Florey и Е. В. Chain получили действующее начало зеленой плесени и дали ему то же название – пенициллин. За открытие пенициллина и его терапевтического действия A. Fleming, H.W. Florey и Е.В. Chain в 1945 г. получили Нобелевскую премию.
В 1942 г. пенициллин был получен в Советском Союзе З. В. Ермольевой.
В структуре пенициллина выделяют бета-лактамный цикл (лактонный цикл с аминогруппой в бета-положении) и тиазолидиновый цикл.

Различают биосинтетические (природные) и полусинтетические пенициллины.
К биосинтетическим пенициллинам относятся:
Полусинтетические пенициллины делят на:
1) пенициллины, устойчивые к пенициллиназе (изоксазолиловые пенициллины);
2) пенициллины широкого спектра действия:
Бензилпенициллины
Бензилпенициллины нарушают связи между цепями пептидогликана клеточной стенки бактерий за счёт:
1) ингибирования транспептидазы, которая способствует образованию пептидных мостиков, соединяющих цепи пептидогликана;
2) снижения активности ингибитора аутолизинов, необходимых для расщепления пептидогликана при делении бактериальных клеток (рис. 82).

Рис. 82. Механизм действия пенициллинов. AM – Ν-ацетилмурамат; АГ – Ν-ацетилглюкозамин; ТП – транспептидаза; АП – аутолизины; И – ингибитор аутолизинов.
В результате нарушается прочность клеточной стенки бактерий и происходит лизис растущих бактерий.
На большинство чувствительных к бензилпенициллинам бактерий эти антибиотики оказывают бактерицидное действие. У фекальных энтерококков отсутствуют аутолизины, и на эти возбудители бензилпенициллины оказывают бактериостатическое действие.
Бензилпенициллины действуют в основном на грамположительные микроорганизмы. Высокоэффективны (являются препаратами выбора) в отношении стрептококков, пневмококков, бледной трепонемы, палочек сибирской язвы, палочек дифтерии, листерий, возбудителей газовой гангрены и столбняка, болезни Лайма. Из грамотрицательных бактерий к бензилпенициллинам чувствительны гонококки и менингококки.
Бензилпенициллины действуют бактерицидно на некоторые штаммы стафилококков, однако большинство штаммов стафилококков (80–90 %) приобрели устойчивость к бензилпенициллинам, так как стафиллококки этих штаммов вырабатывают β-лактамазу-1 (пенициллиназу) – фермент, который разрушает β-лактамный цикл молекулы бензилпенициллинов.
Не действуют бензилпенициллины на шигеллы, сальмонеллы, синегнойную палочку, гемофильную палочку, клебсиеллы, риккетсии, легионеллы, моракселлы, микоплазмы, хламидии, бактероиды, микобактерии туберкулёза.
В желудке бензилпенициллины разрушаются хлористоводородной кислотой, поэтому внутрь эти препараты не назначают, а вводят обычно внутримышечно.
Бензилпенициллины проникают в полость перикарда, плевральную полость, суставы через плаценту, но плохо проникают через гематоэнцефалический барьер (концентрация в спинномозговой жидкости – около 1 % от концентрации в крови). Однако при воспалении мозговых оболочек (менингиты) проницаемость гематоэнцефалического барьера повышается и концентрация бензилпенициллинов в спинномозговой жидкости повышается до 5 % от концентрации в крови.
Бензилпенициллины на 90 % выделяются почками (секретируются в проксимальных канальцах почек), а также выделяются со слюной, с желчью, молоком.
В медицинской практике применяют в основном бензилпенициллин (натриевая соль бензилпенициллина), прокаина бензилпенициллин, беизатина бензилпенициллин. Указанные препараты выпускают во флаконах в виде сухого вещества, которое разводят перед введением и вводят внутримышечно. Бензилпенициллин (натриевую соль бензилпенициллина), кроме того, можно вводить внутривенно.
Дозируют препараты бензилпенициллина в ЕД или граммах (1 млн ЕД = 600 мг).
При внутримышечном введении препараты различаются по скорости наступления эффекта, концентрации в крови, длительности действия.
Бензилпенициллин (Benzylpenicillinum; натриевая соль бензилпенициллина) вводят чаще всего внутримышечно. После введения в крови быстро создается высокая концентрация препарата, которая удерживается около 4 ч.
Препарат особенно показан при острых бактериальных инфекциях – острых стрептококковых инфекциях (тонзиллит, эндокардит, рожа, скарлатина), круппозной пневмонии (вызывается пневмококками), абсцессах мозга, ЛОР-инфекциях, клещевом боррелиозе (болезнь Лайма), дифтерии, сибирской язве, лептоспирозе, газовой гангрене, остеомиелите и других инфекциях, вызванных чувствительными к бензилпенициллину микроорганизмами. При стрептококковом эндокардите, менингококковом менингите, сибирской язве препарат вводят внутривенно медленно или капельно.
Прокаина бензилпенициллин (Procaini benzylpenicillinum; прокаиновая соль бензилпенициллина; новокаиновая соль бензилпенициллина) после внутримышечного введения всасывается медленно; концентрация в крови ниже, чем при введении натриевой соли, однако продолжительность действия значительно больше – до 12 ч. Применяют прокаина бензилпенициллин в основном при хроническом течении заболеваний – при сифилисе (по 600¢000 ЕД 2 раза в сутки в течение 10 дней), сибирской язве, дифтерии, инфекциях ротовой полости.
Бензатина бензилпенициллин (Benzatini benzylpenicillinum; бициллин-1, экстенциллин, ретарпен) после внутримышечного введения всасывается очень медленно; концентрация в крови невысокая; длительность действия препарата составляет (в зависимости от дозы) 1–2 недели. Применяют бензатина бензилпенициллин для лечения сифилиса. При лечении первичного сифилиса препарат вводят внутримышечно в дозе 2,4 млн ЕД 2–3 раза с интервалами в 1 неделю. Кроме того, бензатина бензилпенициллин применяют для профилактики сезонных обострений ревматизма, при стрептококковом тонзиллите, фарингите, роже, дифтерии.
Чтобы ускорить действие бензатина бензилпенициллина, к нему добавляют натриевую и прокаиновую соли бензилпенициллина (Бициллин-3) или только прокаиновую соль (Бициллин-5). Бициллин-3 вводят внутримышечно 1 раз в 6 дней, а бициллин-5 – 1 раз в 4 недели.
Бензилпенициллины в целом малотоксичны, но могут вызывать реакции гиперчувствительности – крапивницу, гипертермию, боли в суставах, сыпи, ангионевротический отёк, анафилактический шок. Возможны гемолитическая анемия, интерстициальный нефрит, нейтропения, тромбоцитопения. В больших дозах или при тяжёлой почечной недостаточности бензилпенициллины могут вызывать энцефалопатию, судороги, кому.
Феноксиметилпенициллин
Феноксиметилпенициллин (Phenoxymethylpenicillinum) по спектру противомикробного действия сходен с бензилпенициллинами, но менее эффективен. В отличие от бензилпенициллинов, устойчив к действию хлористоводородной кислоты желудочного сока.
Назначают феноксиметилпенициллин внутрь 4 раза в сутки в тех случаях, когда нет необходимости срочного действия, – для профилактики сезонных обострений ревматизма, при хроническом стрептококковом тонзиллите, фарингите и др.
Последнее изменение этой страницы: 2016-09-05; Нарушение авторского права страницы
Важная особенность бактериальной клетки, отличающая ее от клеток млекопитающих, – прочная клеточная стенка, окружающая цитоплазматическую мембрану. Эта стенка предохраняет бактериальную клетку от действия осмотического давления, которое в ней приблизительно на 20 атм выше, чем в жидкостях макроорганизма. Прочность клеточной стенке придают пептидогликаны, соединенные ковалентными связями. У грамположительных бактерий стенка имеет толщину 20-80 нм и представляет собой единственную структуру снаружи от цитоплазматической мембраны, у грамотрицательных бактерий она намного тоньше (1 нм) и покрыта наружной мембраной.
Препараты, нарушающие какое-либо звено синтеза пептидогликанов, их транспорт из клетки и образование пептидных мостиков между их молекулами, подавляют рост бактерий и в большинстве случаев вызывают их гибель.
Молекула пептидогликана состоит из:
– остова из двух чередующихся моносахаридов – N-ацетилглюкозамина и N-ацетилмурамовой кислоты;
– боковых пептидов (обычно из 4 аминокислотных остатков);
– пептидных мостиков, перекрестно связывающих боковые пептиды.
Пептидогликаны синтезируются из субъединиц (дисахарид плюс боковой пептид), которые образуются в цитоплазме, а затем транспортируются через цитоплазматическую мембрану на поверхность клетки. В ходе последующего образования пептидных мостиков происходит отщепление концевой аминокислоты боковых пептидов.
Антибактериальные препараты подавляют синтез клеточной стенки несколькими способами.
Ø Циклический полипептидный антибиотик бацитрацин подавляет активацию липидных переносчиков, обеспечивающих транспортировку водорастворимых субъединиц пептидогликанов через мембрану. Субъединицы накапливаются в цитоплазме, и синтез пептидогликанов прекращается.
Ø Высокомолекулярные гликопептиды ванкомицин и тейкопланин связываются с концевыми аминокислотными остатками (D-аланил-D-аланин) боковых пептидов, когда субъединицы находятся уже на поверхности цитоплазматической мембраны, но еще соединены с липидными переносчиками.
Ø Гликопептидные антибиотики создают стерические препятствия объединению субъединиц в макромолекулу пептидогликана.
Ø Бета-лактамные антибиотики – пенициллины, цефалоспорины, карбапенемы и монобактамы, содержащие четырехчленное бета-лактамное кольцо, препятствуют образованию пептидных мостиков и объединению пептидогликанов в единую структуру. Реакцию образования связи между аминокислотными остатками пептидных мостиков и предпоследним остатком D-аланина боковых пептидов (транспептидирование) катализирует фермент транспептидаза, а необходимая для этого энергия выделяется при отщеплении конечных D-аланиновых остатков боковых пептидов. Бета-лактамные антибиотики, обладающие пространственным сходством с субстратом реакции D-аланил-D-аланином, образуют ковалентную ацильную связь с активным центром транспептидазы и необратимо ингибируют ее. Поэтому транспептидазы и подобные им ферменты, участвующие в транспептидировании, называют также пенициллинсвязывающими белками.
Почти все антибиотики, подавляющие синтез клеточной стенки бактерий, бактерицидны – они вызывают гибель бактерий в результате осмотического лизиса. В присутствии таких антибиотиков аутолиз клеточной стенки не уравновешивается процессами восстановления, и стенка разрушается эндогенными пептидогликангидролазами