Методика проведения занятия и методические указания по теме.
Тема 15. Использование в вирусологии реакции диффузной преципитации в агаровом геле
Контрольные вопросы
Задание к следующему занятию.
Подведение итогов занятия.
1. В чем отличие непрямой гемагглютинации от прямой?
2. В чем принцип РНГА?
3. Каково практическое использование РНГА?
Цель занятия: ознакомление с методикой постановки реакции преципитации в агаровом геле
Оборудование и материалы: стекла предметные обезжиренные; пипетки градуированные на 2 или 5 мл; пипетки Пастера; гильзы патрона калибра 5,6 мм; кювета 18×24 см с влажной бумагой или ватой, герметически закрывающаяся (полиэтиленом), или чашки Петри с влажной фильтровальной бумагой; перья ученические с ручками; 1,2%-ный агар на физрастворе; сыворотка крови кролика, иммунизированного вирусом ньюкаслской болезни; аллантоисная жидкость куриного эмбриона, зараженного вирусом ньюкаслской болезни; сыворотка кролика нормальная; аллантоисная жидкость куриного эмбриона нормального, мультимедийное оборудование, презентации MS Office Power Point по теме занятия.
Реакция диффузионной преципитации (РДП) в геле (синонимы: реакция гель-преципитации, реакция двойной диффузии в геле) основана на способности к диффузии в гелях антител и растворимых антигенов и отсутствии такой способности у комплекса антиген + антитело.
15.1 Принцип реакции преципитации. Комплекс антиген + антитело образуется при контакте диффундирующих навстречу друг другу гомологичных антигена и антитела. Он осаждается на месте образования в толще геля в виде полосы преципитации.
Диффузией называется проникновение молекул одного вещества между молекулами другого, обусловленное тепловыми движениями молекул. Диффузия возможна в газах, жидкостях, твердых телах и гелях. Гелями называются такие дисперсные системы, в которых жидкая фаза распределена равномерно среди твердой. Обычно гели образуются высокомолекулярными соединениями, которые дают коллоидные растворы (золи), а при охлаждении превращаются в гели, имеющие некоторые свойства твердых тел. К таким соединениям относятся крахмал, желатин, агар-агар и др. В лабораторной практике очень часто используют агаровый гель.
Антитела сыворотки представляют собой молекулы иммуноглобулинов, которые, несмотря на довольно крупные размеры, способны диффундировать в агаровом геле. Антигены вирусов – это вирусные белки. Они могут находиться в составе вирионов, представляя так называемые корпускулярные антигены, крупные размеры которых не позволяют им диффундировать в агаровом геле. Но белки вирусов могут быть и в виде свободных молекул, образующихся в результате деструкции вирионов и (или) разрушения клеток, в которых они образовались. Это так называемые растворимые антигены. Они способны к диффузии в агаровом геле.
Методика постановки РДП в геле состоит в том, что в слое агарового геля делают несколько углублений (лунок) и в них наливают антигены и сыворотки так, чтобы антиген и сыворотка были в соседних лунках. Из лунок антигены и сыворотки начинают диффундировать в слой геля. Диффузия направлена во все стороны от каждой лунки. В пространстве между лунками, содержащими антиген и сыворотку, последние диффундируют навстречу друг другу (двойная диффузия в геле). Если они окажутся гомологичными, то образуется комплекс антиген + антитело, который к диффузии не способен вследствие более крупных размеров. Он оседает (преципитирует) на месте образования в виде беловатой полосы преципитации, которая хорошо заметна на фоне прозрачного геля (рис. 32). Если же диффундирующие друг другу навстречу антиген и сыворотка будут негомологичны, полосы преципитации не образуется.
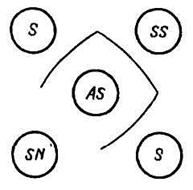
Рисунок 32. Схема РДП
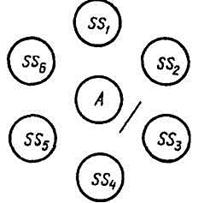
Рисунок 33. Схема РДП для идентификации вируса
15.2 Основные задачи РДП:
–обнаружение в сыворотке крови S антител, гомологичных данному антигену AS (например, вирусу), производится при помощи схемы РДП, показанной на рисунке 52. Если в сыворотке S содержатся антитела к антигену AS, между лунками S и AS образуется полоса преципитации, отсутствующая между лунками с контрольными компонентами SN и AS;
– обнаружение в материале антигена AS, гомологичного известным антителам сыворотки SS, производится по аналогичной схеме РДП (рис. 53). При наличии в исследуемом материале антигена, гомологичного антителам сыворотки SS, между А и SS должна образоваться полоса преципитации, отсутствующая между остальными лунками;
– идентификация неизвестного вируса может быть произведена в РДП по схеме, показанной на рисунке 33. Здесь AS – неизвестный антиген; SS .SS6 – сыворотки, содержащие антитела к известным антигенам. Если полоса преципитации образовалась, например, между лунками с AS и SS3, значит, исследуемый антиген гомологичен антителам сыворотки SS3;
– титрование антител сыворотки. Здесь высшее разведение сыворотки, еще дающее преципитацию с гомологичным антигеном (в нашем примере 1 : 16), служит показателем титра антител в сыворотке SS.
РДП может быть поставлена в чашках Петри, на предметных стеклах и в капиллярах. Наиболее широкое применение в практике нашел метод постановки РДП на предметных стеклах. Для его осуществления необходимо иметь обезжиренные предметные стекла, градуированные пипетки на 2–5 мл и пастеровские пипетки; трубку диаметром около 5 мм с острыми краями или специальный штамп, влажную камеру, ученическое перо или другой инструмент, пригодный для извлечения агарового геля из лунки, 1,0–-1,5%-ный агар на физрастворе или фосфатном буфере с рН 7,2–7,4, антигены, сыворотки.
Специфические антигены и сыворотки должны быть в высоких титрах, обеспечивающих образование комплекса антиген + антитело в количестве, достаточном для образования четко видимой полосы преципитации.
15.3 Постановка РДП.Техника постановки состоит в следующем. Обезжиренные предметные стекла укладывают горизонтально на холодную поверхность (можно на стол). Пипеткой набирают 1,5– 2 мл агара, нагретого до 60 °С, и зигзагообразным движением выливают его сначала по периметру предметного стекла, а потом быстро заполняют его середину, следя за тем, чтобы не образовывались пузыри и волны. Стекла с налитым агаром, слой которого должен быть 1,5–2 мм, оставляют лежать 5–10 мин для’затвердения агара (превращения золя в гель). В слое застывшего агара вырезают лунки. Их количество и взаимное расположение определяются целью, с которой ставят РДП, но диаметр лунок должен быть около 5 мм, а расстояние между соседними лунками – 3–4 мм. Наиболее часто используют два типа расположения лунок.
Для вырезания лунок можно использовать готовый штамп, представляющий собой трубочки с острыми краями, жестко скрепленные в соответствии с типом расположения и количеством лунок. Если готового штампа нет, можно воспользоваться любой трубкой подходящего диаметра, например гильзой от патрона к мелкокалиберной (калибр 5,6) винтовке. В этом случае целесообразно нарисовать карандашом на бумаге количество и взаимное расположение лунок и, подложив этот трафарет под стекло с агаром, по нему вырезать лунки. Остающийся в лунках агар можно извлечь иглой, ученическим пером или пастеровской пипеткой. У образовавшихся лунок дном служит стекло, а стенками – слой агара. Чтобы избежать подтекания жидкостей под агар, рекомендуют лунки заплавить, с тем чтобы они были полностью в слое агара. Для этого можно воспользоваться разными приемами. Один из них состоит в том, что пастеровской пипеткой в лунку вносят горячий (50–60 °С) агар и тотчас отсасывают его обратно. Соприкасаясь на короткое время с холодным дном и стенками лунки, агар успевает частично застыть и покрыть тонким слоем дно и стенки лунки. Схематически это выглядит так, как показано на рисунке 34. Однако если стекла хорошо обезжирены и застывший слой агара прочно сцеплен со стеклом (не «плывет» при наклоне), то и без дополнительной заливки лунок полосы преципитации образуются нормально.
В подготовленные лунки заливают компоненты РДП (антигены и сыворотки). Нужно следить, чтобы компоненты ни в коем случае не переливались через край лунок, а только заполняли объем каждой. Для этого их лучше заливать мелкими каплями с помощью тонко оттянутых пастеровских пипеток.

Рисунок 34. Схема зливки агара
После заливки компонентов РДП предметные стекла помещают во влажную камеру, чтобы предотвратить высыхание агара. В качестве влажной камеры можно использовать любую закрывающуюся емкость (эксикатор, чашку Петри и т. п.), в которую положены намоченные водой вата или фильтровальная бумага. Влажную камеру оставляют при комнатной температуре или ставят в термостат (в термостате диффузия идет быстрее, но незначительно).
Предварительный учет результатов РДП производят через 8–10 ч, основной – через 24 и окончательный – через 48 ч.
Постановка РДП в чашках Петри по технике принципиально не отличается от постановки на предметных стеклах, только тогда слой агара наливают толщиной до 3 мм, лунки делают большего диаметра и на большем расстоянии. Но в этом случае время учета отодвигается до 5–7 дней.
Методика РДП в капиллярах не нашла широкого применения в практике, и на ней мы останавливаться не будем.
Препараты РДП на предметных стеклах можно через. 48–72 ч высушить и окрасить раствором амидного черного. Это позволяет сохранять препарат неопределенно долго и улучшает возможности фотографировать полосы преципитации.
Достоинства РДП следующие: простота техники постановки, быстрота получения ответа, нетребовательность к чистоте компонентов, не требуется стерильной работы, минимальная потребность в компонентах, пригодность для работы с любыми растворимыми антигенами, возможность документирования результата путем фотографирования.
Но все эти достоинства существенно умаляются ее основным недостатком – низкой чувствительностью. Тем не менее РДП достаточно широко пользуются в лабораторной диагностике вирусных болезней животных.
Не нашли то, что искали? Воспользуйтесь поиском:
Цель: индикация, идентификация и титрование антигена или антитела.
Сущность: Антиген и антитело диффундируют на встречу друг к другу в агаровом геле, и при специфичности, в месте соединения образуется комплекс антиген-антитело в виде светлой полосы – линии преципитации.
В агаровом геле по трафарету вырезают 5 луночек, в центральную лунку вносим вирусный материал или стандартную сыворотку с антителами. Вокруг исследуемого объекта, вирус суспензию(заведомо положительный антиген или вирус), заведомо отрицательный антиген, и физиологический раствор. Помещают стекло в трмостат при 37 0 в условиях влажной ткани. Учёт через 6-12-24 часа, контролем являются заведомо полож. и заведомо отриц. антигены. Линия преципитации обязательно должна быть м/у сывороткой и положит. антигеном.
Не должна быть между антигеном и физ. раствотом.
Тоже самое, что и микрометод, только в чашке петри.
Стеклянный каиляр заполняют агаровым гелем, с одной стороны вливают антиген, с другой антитело. Это реакция требует высокой концентрации компонентов.
Семейство Тоговирусов (вирусная диарея крс).
(Togaviridae), семейство вирусов, состоящее из родов Alphavirus, Flavivirus, Rubivirus и Pestivirus. Вирусы содержат однонитчатую РНК линейной формы, к-рая является инфекционной. Вирионы диаметром 50—70 нм (альфавирусы), 40—50 нм (флявивирусы), 70 нм (рубивирусы), 40 нм (пестивирусы). Для капсида альфавирусов свойствен икосаэдральный тип симметрии. Род флявивирусов включает 57 вирусов, из них ряд вирусов, имеющих значение в вет. и мед. патологии,— энцефалитов клещевого, энцефаломиелита овец, омской геморрагич. лихорадки, лихорадок жёлтой, К роду рубивирусов относятся возбудители краснухи и, возможно, артерита лошадей, к роду пестивирусов — возбудители диареи коров (комплекс), лихорадки свиней (. Классическая чума свиней),
Вирусная диарея крупного рогатого скота Остро протекающая контагиозная болезнь, характеризующаяся лихорадкой, диареей, ринитом, эрозийноязвенным воспалением слизистых пищеварительного тракта. Заболевание установлено в 1946 г. Ольсороном и сотрудниками в США.
Возбудитель: РНКсодержащий вирус, относится к сем. Togaviridae, роду Pestivirus; имеет сферическую форму (Гиллепси, 1961 г.). Вирус сохраняется годами при — 20°С, в культуральной жидкости не теряет биологическую активность до 1 года, в крови, в лимфатических узлах, селезенке и др. патологическом материале — до 6 мес. При температуре 25°С в течение 1 сут вирус практически не снижает биологическую активность, при 37°С погибает через 5 сут. Вирус чувствителен к эфиру, хлороформу, трипсину и дезоксихолату натрия.
Эпизоотология. Течение и симптомы. Восприимчивы: телята в возрасте от 6 мес до 2 лет.
Инкубационный период: 6—9 суток.
Источник инфекции: больные животные и вирусоносители.
Пути передачи: алиментарный, через обслуживающий персонал.
Симптомы: при остром течении температура повышается до 40—42°С, депрессия, потеря аппетита, истечение из носа, эрозии и язвы на слизистой носовой полости, изъязвления кожи на венчике, кал зловонный, жидкой консистенции, с пеной и слизью; гибель на 2—3 сутки. У коров и молодняка старшего возраста — абортивная форма.
Патолого-анатомические изменения. Обнаруживают подкожные студенистые отеки, гиперемию легких, участки уплотнения красного цвета, окруженные зоной эмфиземы. Слизистая трахеи, бронхов и бронхиол гиперемирована и покрыта слизистогнойным экссудатом. Между долями легкого иногда находят фиброзную ткань. Отмечают также отечность, гиперемию или некроз заглоточных, шейных, бронхиальных и средостепенных лимфоузлов.
Диагностика. В лаборатории проводят РП в агаровом геле, РН в культуре тканей, иммунофлюоресценцию, биопробу на телятах. От больных животных в ранней’стадии болезни отбирают кровь, смывы с носовой полости, фекалии, от вынужденно убитых или павших животных направляют часть различных отделов кишечника, носовой перегородки трахеи, легких, селезенки, лимфоузлы; от абортированных плодов берут кусочки паренхиматозных органов, околоплодную жидкость.
Дифференциальная диагностика. При диагностике вирусной диареи необходимо исключить чуму, злокачественную катаральную горячку, ящур, инфекционный ринотрахеит, парагрипп3, аденовирусную, реовирусную, коронавирусную инфекцию крупного рогатого скота, паратуберкулез, некробактериоз (см. выше).
Профилактика и лечение. Лечение: средства специфической терапии не предложены, проводят симптоматическое лечение.
Профилактика: рекомендуется убой больного скота и проведение ограничительных мероприятий.
Сплит-вакцины, методы получения.
Вакцины из расщеплённого вириона (сплит) после обработки эфира содержат осколки разрушенных вирусных частиц (АГ + баластные примеси).При обработке вирионов этиловым эфиром удаляются липиды.
3 метода получения:
1. получаем большое количество вирусов, их выделяют и получают, имунногенные субъединицы – сплит-вакцины (дорогой способ).
2. Химический синтез специфического иммуногена, но для этого над знать структуру и амминокислотный состав Аг. После их синтеза их соединяют белком носителем. Затем эту смесь используют в качестве вакцины.
3. Генная инженерия. Установлена у отдельных вирусов. Мозаичность генов, т.е. гены кодируются определённый белок имеют вставки, которые не имеют отношения к синтезу белка. Чтобы ген-инфекция реализовалась, вставки вырезают специальными ферментами. Генноинженерные вакцины получают с помощью биотехнологий.
Физическая структура вирусов
.Вирусы имеют каждый свою морфологию.Вирусная частица хорошо приспособлена к переносу НК от одной клетки к другой. Различают:
– вирусные частицы, имеющие липидную оболочку,
– вирусные частицы не имеющие наружной оболочки.
– кубической (икосаэдрической) формы.
Суб единица вируса – единая, уложенная определенным образом полипептидная цепь. Капсид – белковый чехол, окружающий ДНК.
Репродукция вирусов
Репродукция вируса – это образование многочисленных копий вирусов (вирусных нуклеиновых кислот) и индуцирование биосинтеза вирусных белков с последующей самоорганизацией этих компонентов в зрелые вирусные вирусные частицы. Вирусы покидают клетку путём взрыва, в том случае, если клетка энергетически истощается, и погибает. Иногда вирусы выходят почкованием (обвиваются клеточной оболочкой), при латентных инфекциях вирус может мирно существовать с клеткой некоторое время.
Основные особенности репродукции.
– наличие РНК или ДНК
– многообразие форм и структуры геномов
– почти все вирусные ДНК способны реплицироваться независимо от ДНК клетки, тогда как клеточные РНК могут синтезироваться только на матрице клеточной ДНК.
– Разобщенный во времени и пространстве (дезъюнктивный) биосинтез структурных компонентов вирусов.
– Вирусы не имеют собственных белок-синтезирующих систем, а используют для этих целей системы клетки.
Наличие большого разнообразия механизмов репликации. Под адсорбцией принято понимать первичный контакт вируса с клеткой. Часто этот контакт сначала бывает очень слабым – обратимая адсорбция. Затем прочность контакта возрастает – необратимая адсорбция. Термин «проникновение» ошибочен потому, что он подразумевает активное воздействие на атакуемую клетку определенной части вириона, что не было доказано. Более вероятно, что во многих случаях на самом деле имеет место совсем другой процесс – прикрепление вируса к клетке вследствие физико-химической комплементарности между поверхностью вируса и молекулами рецепторов, находящихся на поверхности клетки, индуцирует в клетке изменения, необходимые для проникновения в нее вируса. Процесс начинается со случайных столкновений множества вирионов с поверхностью клетки. Участок связывания на поверхности вириона, непосредственно взаимодействующий с рецептором клетки, может состоять из индивидуального структурного вирусного белка, а может и представлять собой мозаику из нескольких белков капсида (по-видимому, именно так обстоит дело у пикорнавирусов). Рецептором во всех случаях служит расположенный на поверхности клетки белок или гликопротеид. На поверхности клетки имеются различные рецепторы, каждый из которых специфичен для своего вируса. Специфичность этих рецепторов не абсолютна, что приводит к возможности группировки вирусов по этому свойству в своеобразные «семейства». Следует подчеркнуть, что сам факт адсорбции вируса на клетке еще никоим образом не означает инициации вирусной инфекции. Связи, образующиеся при адсорбции между вирусом и клеткой, могут быть «слабыми»,, а адсорбция «обратимой», т.е. вирион может покидать поверхность клетки. Однако некоторые из адсорбировавшихся на клетке вирионов связываются с ней более прочными «необратимыми» связями. Следующий этап после прочного прикрепления вириона к поверхности чувствительной клетки – это проникновение внутрь клетки всего вириона или его части и начало синтеза вирус-специфического белка или вирусной м РНК. Проникновение вирионов в клетку и активация вирусного генома могут происходить у разных вирусов по-разному. Ясно, что вирусы с оболочкой и «голые» вирусы должны проникать в клетку в результате разных физико-химических процессов. Уже давно предполагали, что в основе проникновения в клетку вирусов с оболочкой, вероятно, лежит процесс, в какой-то мере подобный «плавлению мембраны», или процесс «слияния». Что же касается таких относительно больших белковых структур, как голые вирионы, то для них известен только один механизм проникновения в клетку – это фагоцитоз, и уже давно предполагается, что такие вирусы проникают в клетки в результате варианта фагоцитоза, названного «виропексисом». ДНК большинства ДНК-содержащих вирусов синтезируется в ядре клетки. Напротив, белки всех без исключения вирусов синтезируются в цитоплазме. Заражение клеток вирусами в принципе может привести к двум последствиям. Зараженная клетка может либо погибнуть, образовав при этом большое количество вируса (литический тип взаимодействия вирусов с клетками), либо продолжать жить и делиться, синтезируя небольшие количества вируса. Многие вирусы лизируют клетки очень редко, и обычно в зараженных клетках устанавливается состояние устойчивого равновесия – образуется персистентно инфицированная культура клеток. Установлено, что при успешной литической инфекции в зараженных клетках происходит пять четко отличающихся друг от друга событий, реализуемых функционально активными вирус-специфическими белками. Это следующие события: 1) подавление вирусом ряда клеточных функций; 2) синтез вирусных м РНК; 3) репликация вирусного генома; 4) морфогенез вирионов; 5) освобождение вирионов из клетки
Основана на способности к диффузии в гелях антител и растворимых антигенов.
Диффузией называют проникновения молекул одного вещества между молекулами другого, обусловленные тепловыми движениями молекул.
Гелями называют такие дисперсные системы, в которых жидкая фаза распределена равномерно среди твердой. В лабораторной практике очень часто используют агаровый гель.
При создании условий, в которых они будут диффундировать навстречу друг другу, при их встрече образуется комплекс антиген + антитело. Этот комплекс не обладает способностью диффундировать в толще агарового геля и выпадает в осадок (в участках, где создаются их эквивалентные концентрации) в виде полосы преципитации, видимой невооруженным глазом. Если же диффундирующие антигены и антитела не гомологичны друг другу, то полосы преципитации не образуется.
Для создания условий диффузии в слое агара делают лунки, в которые заливают компоненты. Количество и взаимное расположение лунок зависит от решаемой задачи.
РДП позволяет решить следующие диагностические задачи: обнаружить и идентифицировать неизвестный выделенный вирус путем исследования его с различными заведомо известными сыворотками (антителами);
обнаружить и определить титр антител в сыворотках с помощью известного антигена.
РДП может быть поставлена в чашках Петри (макрометод) и на предметных стеклах (микрометод).
Методика постановки макрометода по технике принципиально не отличается от постановки микрометода, только в этом случае в чашку Петри наливают 20—25 мл расплавленного агара и в застывшем геле делают лунки диаметром 5—6 мм по специальной схеме (расстояние между лунками 4—5 мм ) и вносят соответствующие компоненты.
При постановке РДП на предметных стеклах препарат можно через 48—72 ч высушить и окрасить раствором амидного черного, что позволит его сохранить и сфотографировать.
Достоинства РДП: простота техники постановки; быстрота получения ответа; не требует стерильной работы, особой чистоты компонентов; возможность документирования результата путем фотографирования. Недостаток РДП — низкая чувствительность.
Иммунодиффузия в электрическом поле (встречный электрофорез, ракетный электрофорез) позволяет повысить чувствительность метода в 10—20 раз и более.
Одна из разновидностей РДП — реакция радиальной иммунодиффузии (РРИД).
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.